Wie kunnen deelnemen aan de e-PIL pilot?
Tijdens de startfase van de pilot konden uitsluitend fabrikanten die lid zijn van de VIG deelnemen. Vanaf het tweede kwartaal van 2025 wordt de pilot ook opengesteld voor externe fabrikanten.
Welke medicijnen zijn geschikt om aan de e-PIL pilot deel te nemen?
Een medicijn dat aan de criteria voldoet mag deelnemen. Het is aan te raden om daarbij te kiezen voor een medicijn met een hoge doorlooptijd, zodat het snel zonder bijsluiter beschikbaar kan komen.
Welke criteria gelden er voor deelname aan de e-PIL pilot?
Het geneesmiddel mag uitsluitend in ziekenhuizen worden gebruikt en wordt direct toegediend aan de patiënt door de zorgverlener, zonder tussenkomst van de patiënt. In een aantal gevallen wordt medicatie vanuit het ziekenhuis thuis toegediend.
- Deze medicijnen mogen alleen meedoen wanneer ze vooraf in de ziekenhuisapotheek voor toediening gereed gemaakt zijn en niet meer vanuit de originele verpakking verstrekt.
- De verpakkingen mogen geen bijsluiters in meerdere talen bevatten, zg ‘shared packs’. Uitzondering geldt voor Benelux verpakkingen die aan de pilot in Nederland en België meedoen, omdat in België eenzelfde pilot loopt.
Stelregel: Wanneer de patiënt de originele verpakking ontvangt, moet daar een bijsluiter bij zitten. In dat geval mag het medicijn niet deelnemen aan de pilot.
Wie controleert of een medicijn kan deelnemen aan de e-PIL pilot?
De VIG ontvangt alle aanmeldingen (VIG-leden en externe fabrikanten). De VIG zorgt ervoor dat het medicijn wordt opgenomen in het beoordelingsproces. Alle aanmeldingen worden gecontroleerd op basis van de gestelde criteria. De eerste beoordeling gebeurt door het NVZA. Hierna wordt het medicijn gecontroleerd door het CBG. Na de beoordeling van het CBG wordt de lijst van deelnemende producten geactualiseerd en gepubliceerd op webpagina van het CBG. Bekijk hier de processtappen in de workflow.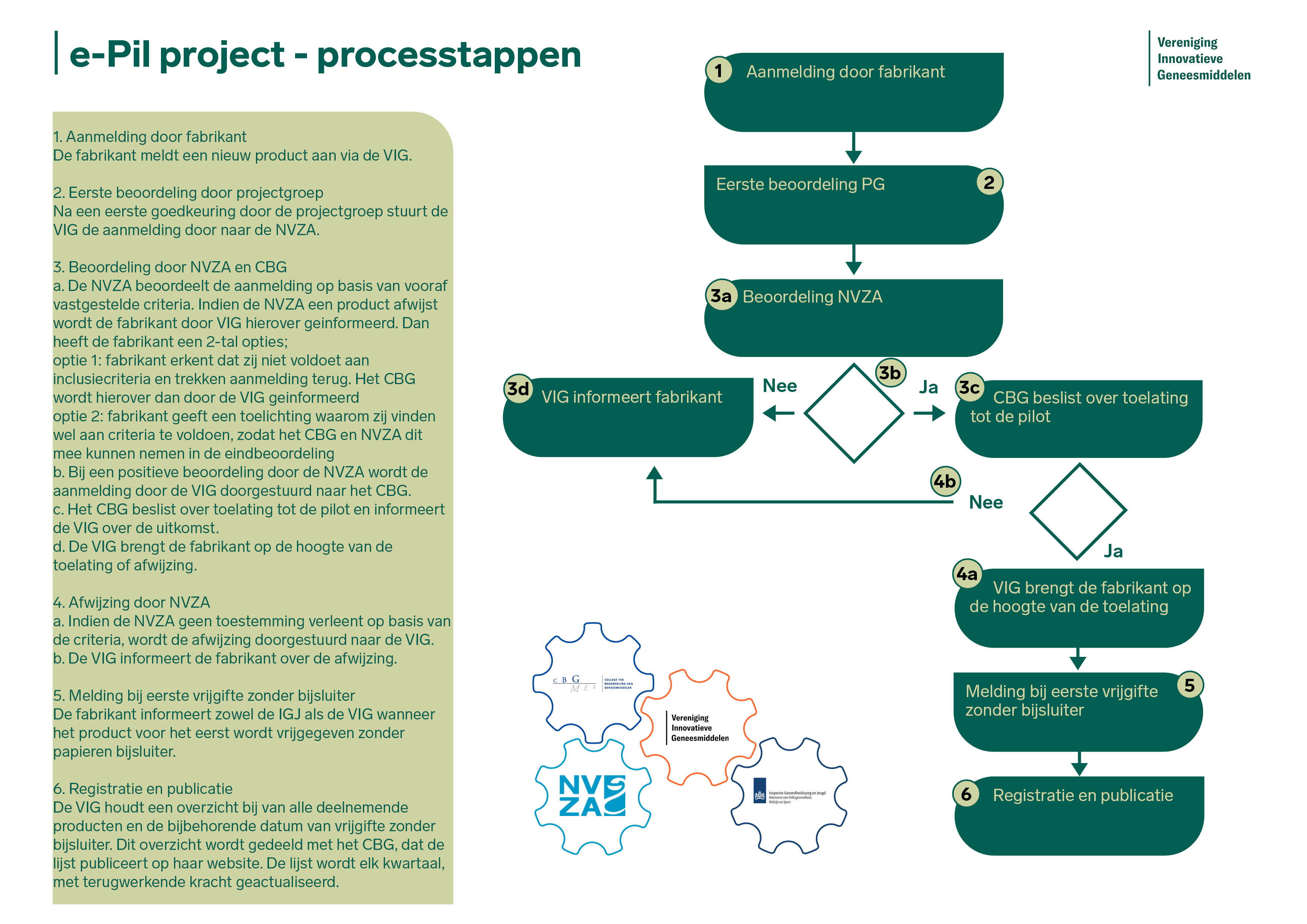
Wordt er een formele wettelijke goedkeuring verstrekt door het CBG waarin staat dat fabrikant zonder fysieke bijsluiter mag leveren, en hoe lang is deze goedkeuring geldig?
Het CBG verleent toestemming door de lijst met deelnemende medicijnen op haar webpagina te publiceren. Daarnaast zal het CBG de VIG en deelnemende fabrikanten informeren over een aanstaande update van deze lijst. Deze aankondiging geldt als verklaring van toestemming en blijft van kracht gedurende de looptijd van de pilot, tot 31 december 2026.
Waar kan ik alle deelnemende producten terugvinden?
Een actuele lijst met alle deelnemende producten is terug te vinden op de webpagina van het CBG. Deze lijst wordt eens per kwartaal geactualiseerd. Data van actualisering in 2025:
- Q1 1 april 2025 (enkel VIG-leden)
- Q2 1 juli 2025 (VIG-leden en externe fabrikanten)
- Q3 1 oktober 2026 (VIG-leden en externe fabrikanten)
- Q4 1 januari 2026 (VIG-leden en externe fabrikanten)
Kan een deelnemende partij zich terugtrekken uit de e-PIL pilot?
Ja, dit is mogelijk. Tijdens het productieproces kan het voorkomen dat bepaalde aanpassingen niet gerealiseerd kunnen worden door onvoorziene omstandigheden (productieproces kan niet op juiste wijze worden ingericht). Geneesmiddelen kunnen daarom gedurende de pilot van de lijst van deelnemende producten worden verwijderd. De actuele lijst is te vinden op de webpagina van het CBG en wordt elk kwartaal geactualiseerd (zie http://www.geneesmiddeleninformatiebank.nl).
Hoe zorgen we ervoor de e-PIL up-to-date blijft na variaties en wijzigingen gedurende de levenscyclus van de bijsluiter?
Om de e-PIL actueel te houden, moeten wijzigingen in de bijsluitertekst, zoals bij variatieaanvragen, net als voorheen aan het CBG worden doorgegeven. Na goedkeuring wordt de herziene bijsluiter in pdf-formaat gepost op de geneesmiddeleninformatiebank. Deze website zorgt ervoor dat altijd de nieuwste versie van de bijsluiter beschikbaar is voor de gebruikers. Zo wordt gewaarborgd dat de e-PIL consistent wordt bijgewerkt gedurende de levenscyclus van het geneesmiddel.
Hoe verloopt de communicatie (met alle betrokkenen) tijdens de deelname aan de e-PIL project?
Tijdens de pilot zal de VIG alle betrokkenen op de hoogte houden. Wanneer de informatie specifiek relevant is voor ziekenhuisapothekers, zal de NVZA haar leden informeren. Daarnaast kunnen leden via het ledennet van de NVZA meer informatie vinden over de e-PIL pilot.
Wat gebeurt als pilot stopt en er geen verlenging is (EU wetgeving is nog niet goedgekeurd)? Mag ik mijn voorraden medicijnen zonder papieren bijsluiter leveren?
Als de pilot stopt zonder verlenging en de EU-wetgeving nog niet is goedgekeurd, mogen reeds vrijgegeven batches zonder papieren bijsluiter worden uitverkocht. Dit is toegestaan omdat deze batches al zijn vrijgegeven door de QP en lokaal door QA zijn goedgekeurd. De IGJ ziet geen juridische grond om de verkoop te blokkeren.
Wel gelden de volgende voorwaarden:
- Uitverkoop, geen nieuwe marktintroductie: De verkoop moet beperkt blijven tot bestaande voorraden en mag niet neerkomen op het actief op de markt brengen van grote hoeveelheden die niet in verhouding staan tot het reële verbruik.
- Geen nieuwe productie: Aangezien de wettelijke basis ontbreekt na het einde van de pilot, mogen er geen nieuwe batches zonder papieren bijsluiter worden geproduceerd of vrijgegeven.
Kortom, bestaande voorraden mogen worden verkocht binnen de grenzen van een normale uitverkoop, maar verdere productie zonder papieren bijsluiter is niet toegestaan.
Waar kan ik mij aanmelden voor de e-PIL pilot?
Zowel VIG-leden als externe fabrikanten kunnen zich aanmelden om deel te nemen aan deze pilot via het formulier op deze webpagina.
Is het mogelijk een nieuw product aan te melden voor de e-PIL pilot?
Ja, het is mogelijk om een nieuw product aan te melden voor de e-PIL pilot, ook als dit nog wacht op een EMA-opinie en handelsvergunning. Fabrikanten mogen proactief hun verpakkingsproces hierop inrichten, dus zonder papieren bijsluiter, mits zij deelnemen aan de pilot. Voorwaarden voor aanmelding:
- Het product moet zijn aangevraagd op basis van het SmPC (Samenvatting van de Productkenmerken).
- Het SmPC wordt gebruikt als basis voor de beoordeling van toelating tot de pilot.
Zowel VIG-leden als externe fabrikanten kunnen zich aanmelden om deel te nemen aan deze pilot via het aanmeldingsformulier.
Wanneer communiceert de fabrikant dat de start van bijsluitervrije verstrekking van verpakking is ingegaan?
Zodra het batchnummer van een partij bijsluitervrije verpakkingen bekend is, dient dit te worden doorgegeven aan:
• VIG via: w.bakker@innovatievegeneesmiddelen.nl
• IGJ via: igj-qdefect@igj.nl
De batchnummers (eerste vrijgegeven batch) en de bijbehorende data van vrijgifte worden gepubliceerd op de webpagina van het College ter Beoordeling van Geneesmiddelen (CBG).
Deze lijst wordt ieder kwartaal — met terugwerkende kracht — geactualiseerd.