Herziening van de wetgeving is hoognodig. De huidige wetgeving is – deels – al meer dan twintig jaar oud, en geschreven in en voor een andere tijd. De documenten voor de nieuwe Farmaceutische Strategie voor Europa bevatten voorstellen tot modernisering van de Europese wetgeving voor geneesmiddelen die de kwaliteit van geneesmiddelen moet verzekeren, de toegang tot innovatieve geneesmiddelen voor patiënten zou moeten vereenvoudigen en Europa aantrekkelijker moet maken voor bedrijven.
Achterop geraakt
Carla Vos, adjunct-directeur van de Vereniging Innovatieve Geneesmiddelen herkent en onderschrijft de doelen van de Europese Commissie. ‘We zijn blij dat de Commissie de regelgeving voor toelating van nieuwe geneesmiddelen wil moderniseren en vereenvoudigen. We zien dat er veel ongelijkheid is tussen patiënten binnen Europa als het gaat om toegang tot nieuwe innovaties. In veel landen zijn nieuwe medicijnen niet of nauwelijks beschikbaar, terwijl in andere landen dit een stuk beter gaat. Ook hopen we dat de voorstellen ertoe leiden dat Europa weer aantrekkelijker wordt voor het ontwikkelen van nieuwe geneesmiddelen, iets dat nu vooral in de Verenigde Staten gebeurt. En dat is nodig: in de afgelopen 25 jaar is de geneesmiddelontwikkeling in Europa achterop geraakt bij de ontwikkelingen in de Verenigde Staten en Azië. Ongeveer de helft van de nieuwe geneesmiddelen kwam uit Europa 25 jaar geleden, nu is dat nog maar een vijfde.’
Afzwakken internationale positie
Vos heeft echter ook zorgen over de verdere plannen van de Commissie. ‘Een aantal voorstellen van de Commissie zijn onbegrijpelijk in het licht van het stimuleren van geneesmiddelontwikkeling, ze kunnen ertoe leiden dat onze internationale positie verder afzwakt.’ Vos doelt hierbij op voorstellen die de stimulans voor geneesmiddelontwikkeling afbouwen. Zo wordt de gegevensbescherming voor geneesmiddelen standaard fors ingeperkt en kunnen bedrijven alleen extra stimulansen krijgen als aan bepaalde, strenge eisen wordt voldaan. Zo moeten nieuwe geneesmiddelen in alle EU-lidstaten beschikbaar zijn voor patiënten. Vos: ‘Een dergelijke voorwaarde is onuitvoerbaar voor geneesmiddelenbedrijven, omdat wij niet als enige partij hierover beslissen. Het enige wat we kunnen, en waar we ons toe kunnen verplichten, is binnen twee jaar in elk EU-land vergoeding aanvragen en prijsonderhandelingen aangaan. Maar, elk EU-land heeft zijn eigen vergoedingsbeleid, met eigen kaders, regels en barrières, waar de industrie geen invloed op heeft. Ik zie niet in hoe dit EU-beleid deze punten kan oplossen.’
Zorgvuldige impactanalyse
Andere zorgen van Vos liggen op het terrein van het onderzoek naar geneesmiddelen voor kinderen en voor patiënten met zeldzame ziektes. ‘Op deze terreinen zijn nog veel ziektes waar geen behandeling voor is. Het is nu niet duidelijk hoe de voorstellen van de Commissie bedrijven gaan helpen om geneesmiddelen hiervoor te ontwikkelen. Ik hoop dan ook dat de Commissie een zorgvuldige impactanalyse zal uitvoeren, zodat we weten wat de gevolgen zijn van de keuzes die de Commissie en de lidstaten gaan maken. Het is onwenselijk en onacceptabel als deze voorstellen, die bedoeld zijn om nieuwe innovatieve geneesmiddelen bij patiënten te krijgen, in de praktijk een averechts effect hebben. We gaan dan ook graag met de overheid en andere (zorg)partijen in gesprek als er meer helderheid is na een impactanalyse. Zo kunnen we gezamenlijk ervoor zorgen dat bij deze belangrijke wetswijziging oog blijft voor patiënt, kwaliteit van zorg en een samenleving mét een duurzame geneesmiddelensector!’
Lees ook: Farmabedrijven reageren afwijzend op EU-plannen voor medicijnen (fd.nl)
Meer nieuws

Europese Biotech Act versterkt positie van Europa in medische innovatie

Innovatiekloof met VS en China onderstreept het belang van meer medische R&D in Nederland
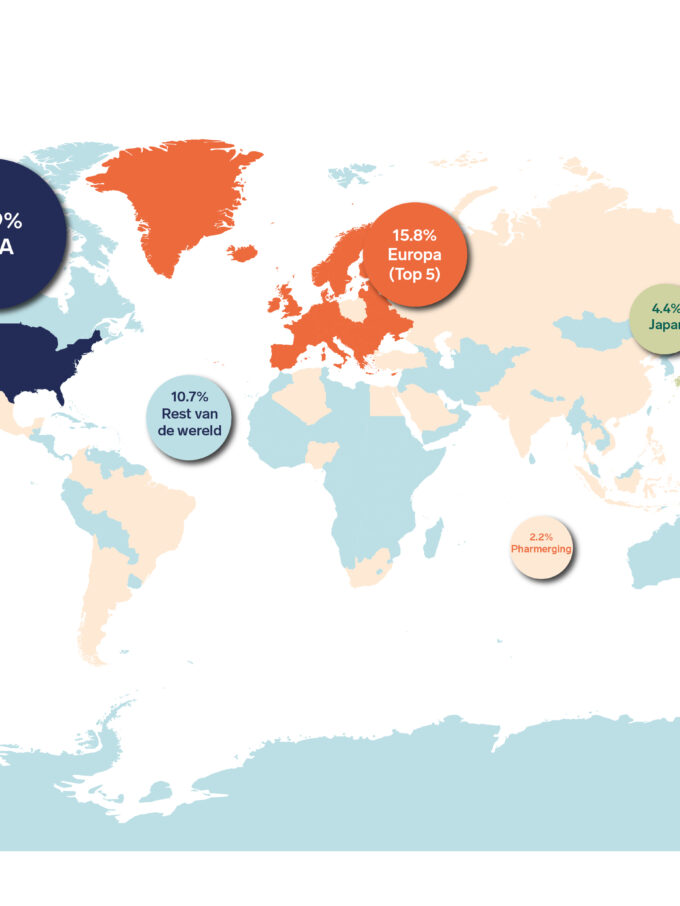
Omzet nieuwe geneesmiddelen in VS vier keer zo groot als in Europa

